Шушляпин О.И.,
к. м. н. Харьковский Национальный Медицинский Университет
Меру отпущенной человеческой жизни люди часто представляли себе как горящую свечу, зажженную на небесах в момент рождения человека. И пока горит эта свеча – человек живет. Конечно, так хочется, что бы эта свеча горела дольше, или не сгорала вовсе… Но возможно ли это? Мы знаем, что старение и смерть – это биологически обусловленные, генетически запрограммированные процессы. И избежать конца, к которому нас неизбежно приближает отсчет неумолимых биологических часов, нельзя. Или, все-таки, можно?
Старение является домокловым мечом, занесенным над каждым человеком, начиная с 20-ти летнего возраста. Уже с этого юного возраста с каждым годом растет угроза возраст-зависимых заболеваний: инфаркта, инсульта, онкологических заболеваний, патологий опорно-двигательного аппарата и пр. патологий пожилого возраста. Развитие этих изменений связано с работой механизма старения, который назван «малыми биологическими часами». Это своего рода счетчик, который отсчитывает количество делений клеток от общего, отпущенного нам природой числа клеточных делений, количество которых ограничено. Это открытие было сделано еще в 60-е годы ученым из Калифорнийского университета Леонардом Хейфликом, наблюдавшим деление человеческих клеток в культуре. Он открыл интересную закономерность, которая шокировала весь научный мир :приближаясь к границе 50 делений клетки проявляют признаки старения, а миновав границу – умирают. Причем исследователи пытались изменить эту программу, охлаждая клетки и останавливая процесс деления. Но после возвращения в нормальное состояние клетки как бы «вспоминали», сколько делений из отпущенного лимита уже использовано, и продолжали свой счет только до 5010 делений в целом. Клетки помнят о том, что многое уже позади. Этот эффект наблюдался для всех полностью дифференцированных клеток человека и многих других млекопитающих. Но он не работает для половых и раковых клеток. Почему? Ответ на этот вопрос был найден: все дело в специфичеком ферменте.
Все дело в ферменте
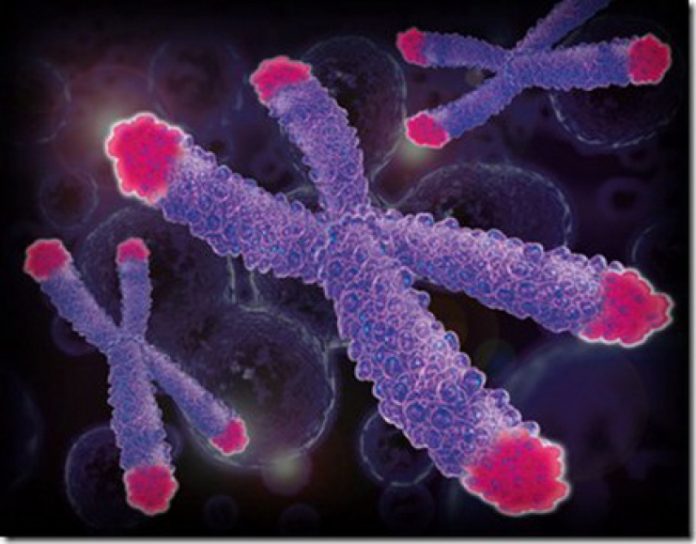
Предел Хейфлика связан с сокращением размера концевых участков ДНК – теломер. Объяснение этому явлению было предложено ученым Алексеем Матвеевичем Оловниковым, сотрудником института химической физики АН России, который описал механизм «малых биологических часов» в рамках теории маргинотомии в 1971 году. Маргинотомия (margo по латыни – край, tome-по гречески — отсечение) – это процесс укорочения ДНК. Он связан с тем, что дочернюю ДНК строит, перемещаясь по матричной цепи, фермент ДНК-полимераза. У него есть «узнающий» и «каталитический» центры, которые пространственно разделены. Когда первый – узнающий- как «локомотив» доходит до конца матрицы, второй – каталитический — , как последний «вагон поезда», останавливается довольно далеко и конец цепи не копирует. А если узнающий центр находится сзади, то по той же причине не скопируется начало цепи. Вот длина «поезда» — расстояние между центрами – и определяет, какой участок цепи не будет скопирован. Таким образом, концевые участки хромосом – теломеры – постоянно укорачиваются, в процессе маргинотомии они по кусочку «приносятся в жертву». Когда после предопределенного числа делений теломеры исчезают совсем, клетка запускает программу апоптоза и умирает. Но еще в 1973 году Оловников предположил, что должен быть мезанизм, препятсвующий укорочению теломеров. Им оказался фермент теломераза, добавляющий особые повторяющиеся последовательности к цепи ДНК на участках теломер. Активная теломераза контролирует, чтобы длина теломерных участков хромосом клетки сохранялась постоянной. Таким образом, концевая «недорепликация» компенсируется, и клетка может делиться сколь угодно долго, пренебрегая пределом Хейфлика. В последние годы было выяснено, что фермент состоит из РНК и белкового компонента. РНК-компонент экспрессируется на постоянном уровне практически во всех клетках, но для поддержания активности теломеразы необходима экспрессия белковой ее части, которая была названа каталитической. Экпериментально было доказано, что искусственная экспрессия гена каталитического компонента теломеразы делает клеточную культуру способной делиться неограниченное число раз, т.е. практически бессмертной.
Кто способен на бессмертие?
Обычные соматические клетки лишены теломеразной активности. Активная теломераза экспрессируется в стволовых, половых и некоторых других типах клеток организма, которым необходимо постоянно делиться для поддержания функциональной активности некоторых тканей и органов (например, клетки эпителия кишечника). Также обнаружена активная теломераза в 85 % раковых опухолей. «Бессмертные» раковые клетки имеют короткие теломеры, но теломераза постоянно достраивает их, позволяя опухоли расти, пока есть пища и кислород. Поэтому именно теломераза может стать отличной мишенью для противораковых препаратов. Открытые в последнее время ингибиторы теломеразы показали высокую эффективность, вызывая гибель раковых стволовых клеток. Механизм их действия заключается в том, что они связываются непосредственно с РНК-матрицей теломеразы, тем самым блокируя ее способность к дальнейшему синтезу теломеры. Игибиторы теломеразы могут помочь не только в лечении раковых опухолей, но и стать подспорьем в лечении некоторых наследственных заболеваний, в частности, связанных с дерматологическими и легочными патологиями. На протяжении нескольких последних лет обсуждается возможность продления теломер путем активации теломеразы. Полагается, что когда нам удасться это сделать, со старением будет покончено.